| РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ |
Применение метода внутреннего стандарта ддя ВЭЖХ-анализа сложных по составу образцов экстрактивных веществ позволяет существенно повысить точность количественного определения индивидуальных соединений. Кроме того, метод ВС исключает появление ошибок анализа, связанных с вариацией объемов проб, вводимых в колонку для ВЭЖХ. Следует особо отметить, что именно вариации объемов проб, обусловленные конструкцией хроматографов марки “Милихром’, делают эти приборы малопригодными для анализа с использованием методов абсолютной градуировки или внешнего стандарта. В то же время они вполне пригодны для массовых анализов с применением метода ВС.
В настоящей работе в качестве ВС предлагается использовать парацетамол, содержащий фенильный хромофор с максимумом полосы поглощения в области 238 нм, что практически совпадает с максимумом полосы поглоения хромофора (С = С – С = О) в структуре ФЭС (242 нм). Вместе с тем следует отметить, что молярный коэффициент поглощения парацетамола в данной области спектра в среде выбранного элюента практически в 3 раза больше, чем у ФЭС. В связи с этим массовая доля выбранного ВС должна быть на порядок меньше в градуированных смесях по сравнению с концентрацией ФЭС.
Количественное определение ФЭС методом ВЭЖХ проводили в 2 этапа. Первый этап – определение градуировочных коэффициентов – коэффициентов пропорциональности между соотношением площадей пиков и концентраций 20Е, ИН, Е и ВС.
|
|
|
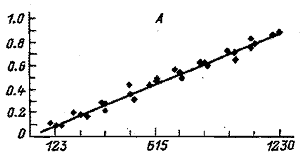
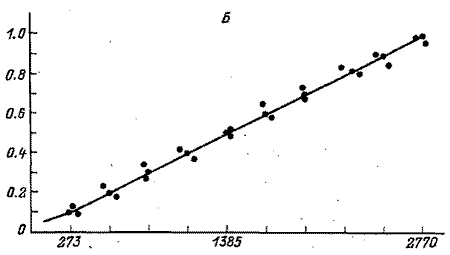
Рис. 2. Градуировочные графики для парацетамола (А)
и для экдистерона (Б)(по оси абсцисс – площадь пика, mB х с;
по оси ординат – концентрация вещества, мг/мл
|
|
|
|
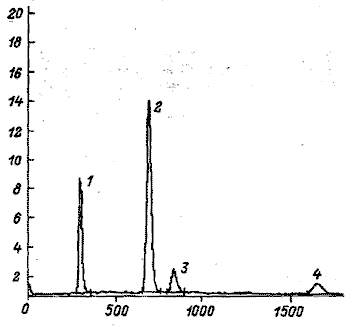
Рис. 3. Хроматограмма экдистероидов Serratula coroпata
1 – парацетамол. 2 – зкдистерон, З – инокостерои, 4 – экдизон.
По оси абсцисс – время ВЗЖХ-анализа, с;
по оси ординат – амплитуда сигнала, мВ
|
|
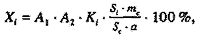 | |
где А1 и А2 – коэффициенты, учитывающие объем исходного экстракта, аликвоту экстракта для концентрирования ЭС на патроне и объем пробы для ВЭЖХ; Ki – калибровочный коэффициент ФЭС; Si – площадь хроматографического пика ФЭС; Sс – площадь пика ВС, мВ х с; а – навеска растительного сырья, мг; mc – масса ВС в пробе, мг | |
Относительную погрешность значений Х вычисляли с помощью соотношения:
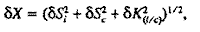
где К(i/c) – коэффициент относительной чувствительности детектора к определяемому компоненту ФЭС и стандарту, который рассчитывали, используя следующее соотношение (где mi – масса i-го компонента)
| 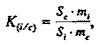 | |
Таблица 1. Метрoлогические характеристики методики определения 20-гидроксиэкдизона (20Е),
инокостерона (ИН) и экдизона (Е) методом микроколоночной ВЭЖХ (P = 0.95)
|
Примечание. X – среднее значение, S – среднее квадратичное отклонение, Sx – ошибка среднего квадратичного отклонения, Δx – доверительный интервал среднего значения, ε – погрешность среднего значения (а = 0.95), n – число определений.
Согласно полученным результатам, ошибка единичного определения с доверительной вероятностью 95 % для 20E находится в интервале 0.6-5.6 %, ИН = 5.2-19.3, Е = 5.0-31.3 %. Следует отметить, что наименьшая погрешность определения ФЭС наблюдается при сравнительно высоком их содержании в растительном сырье и лекарственных формах.
Представленная методика СФ ВЭЖХ дает возможность оценки качества растительного сырья и лекарственных форм, содержащих ФЭС. Она характеризуется достаточно высокой чувствительностью (предел обнаружения 20Е 0.1 мг/л), селективностью определения и рекомендуется для выполнения массовых анализов растительного сырья при скрининге растений на ФЭС, а также для технологического контроля при производстве фармацевтических препаратов, содержащих 20Е, ИН и Е.
|
| СПИСОК ЛИТЕРАТУРЫ |
Амосова Е.Н., Зуева Е.П., Гольберг Е.Д. Растения Сибири и Дальнего Востока – источники поиска лекарственных препаратор для онкологической практики // Фармакология и токсикологня. 1991. Т. 54, № 6. С. 3-7.
Ахрем А., Ковганко Н. Экдистероиды: химия и биологическая активность. Минск, 1989.
Вересковский В.В., Чекалинская И.И., Пашина Г.В. Динамика содержания зклисгерона у видов рода Rhaponticum Ludw. // Растительные ресурсы, 1983. Т. 19, вып. 1. С. 60-65.
Плотников М.Б., Алиев О.И., Васильев А.С., Маслов М.Ю., Чернышова Г.А., Краснов Е.А., З и б арс в а Л. Н. Гемореолотяческая активность экстрактов из надземной части части Lychпis chalcedoпica L. и Rhapoпticит carthamo;des (Willd.) Iljin при эксперимеи¬тальном инфаркте миокарда // Растительные ресурсы, 1999. Т.35, вып. 1. С. 103-107.
Зибарева Л.Н., Балтаев У.А., Свиридова Т.П., Саатов З., Абубакиров Н.К. Виды рода Lychпis L. – перспективные источники экдистероидов // Растительные ресурсы, 1995. Т. 31, вып. 4. С. 1-9.
Зибарева Л.Н., Еремина В.И., Иванова Н.А. Новые экдистероидоносные виды р. Silene L. и динамика содержания в них экдистерона // Растительные ресурсы, 1997. Т. 33, вып. 3. С. 73-76.
Колегова Н.А., Володин В.В. Обращенно-фазовая высокоэффективная жидкостная хроматография экдистероидов в системах, содержащих электронодонорные добавки // Журнал аналитической химии. 1999. Т. 54, № 12. С. 1285-1288.
Новосельская И.Л. Фитоэкдизоны растений рода растений рода Serratиla: Автореф. канд. дис. Ташкент, 1977.
Пат. 2138509 Россия, МКИ6 А 61 К 35/78. Cпособ получения экдистерокдов растения рода Serratula – а-экдизона, экдизона и инокостерона /
Пунегов В.В., Мишуров В.П., Никитина Е.Н.; Ин-т биологии Коми НЦ УрО РАН. № 97121539; Заявл. 22.12.97; Опубл. 27.09.99. Бюл. № 27.
Экдистероиды растений семейства Asteraceae / В.В. Володин, В.П. Мишуров, Н.А. Колегова, Ю.А. Тюкавин, Н.В. Портнягнна, Б.А. Постников. Сыктывкар, 1993. (Науч. докл. Коми НЦ УрО РАН. Вып. 319).
Якубова М.Р., Генкина Г.Л., Шакиров Т.Т., Абубакиров Н.К. Хроматоспектрофотометрический метод определения экдистерона в растительном сырые // Химия природных соединений. 1978. № 6. С. 737-740.
Lаfont R., Реnnеtiеr J.-L., Аndriаnjаfitrimо М. Sample processing for hiпg-реrfопnасе liquid chromatography of ecdysteroids // J. Chromatography, 1982. Vol. 236. P.137-149.
|

