| ВВЕДЕНИЕ |
Rhaponticum carthamoides (Leuzea, maral root, rapontik, левзея, рапонтикум сафлоровидный, маралий корень) и препараты на его основе внесены в Государственную фармакопею СССР IX-XI изданий (1961, 1968, 1987, 1990), Реестр лекарственных средств России (1995, 1998). В реализации биологической активности вида ведущую роль играют фитоэкдистероиды (Сыров и Курмуков, 1976, Slama et al., 1996, Тодоров и др., 2000). В качестве лекарственных средств используются листья, корни и корневища, сухие порошки и вытяжки из лекарственного сырья левзеи (отвары, настои и настойки, жидкие и сухие экстракты).
Экстракт вырабатывающие предприятия из корневищ функционируют в Бийске, Томске и Красногорске (Регистр…, 1993; Здравоохранение…, 1994). В Зональном НИИСХ Севе-ро-Востока (г. Киров) на основе экстракта листьевой части растения разработан жидкий ветпрепарат Биоинфузин (Ивановский, 2000). В Сибирском государственном медицинском университете (Томск), совместно с Институтом общей химии (Новосибирск), созданы новые лекарственные формы на основе ампульных растворов и сухих экстрактов (Краснов, 2006).
С целью повышения концентрации действующих веществ левзеи часто проводят первичную очистку полученного экстракта, без изоляции индивидуальных соединений (препарат “Левзеин” и их аналоги). Технологическая схема состоит из операций по экстрагированию сырья левзеи 20-70 % этанолом; очистки от сопутствующих веществ раствором ацетата свинца или других осадителей – с целью удаления белков, пектиновых веществ, таннинов и органических кислот; фильтрования и обессоливания фильтрата с использованием ионообменных смол (Саратиков и др., 1970; Пунегов и др., 1999). На основе высокоочищенных экдистероидов левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум) выпускается фармпрепарат Экдистен (Машковский, 1993), а также многочисленные его аналоги, таблеточные формы с различной степенью химической чистоты – препараты "Russ Olimpic, Triboxin, Cytodyn ZM" и т.д. (Lafont и Dinan, 2003; Тимофеев, 2004).
Результаты многих сравнительных исследований свидетельствуют, что наблюдается большая разница в дозах и активности экдистероид содержащих субстанций, получаемых из лекарственного сырья левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум) (Федоров и др., 1997; Hamburger et al., 2006, Biskup & Eojkowska, 2006). По всей видимости, фармакологическая активность вида обусловлена сложным комплексом фитоэкдистероидов с продуктами основного и вторичного обмена веществ, происходящих путем суммирования эффектов через минорные составы и посредники.
|
| МЕТОДИКА |
Анализировали подземные и надземные части растений левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум) 9-11 года жизни, собранные в разные фазы развития: почки и корневища – в фазе покоя (ноябрь-декабрь), листья – отрастания, бутонизации и цветения (апрель-май-июнь), семена – плодоношения (июль). Растительный материал сушили при температуре 25…40 °С в тени, относительной влажности воздуха 25-40 %. Средний образец формировали методом квартования. Сухую навеску испытываемых образцов экстрагировали в течение 24 часов 0.1 М фосфатным буфером. Температура 30 оС, гидромодуль 15, рН=6.9, антисептик азид натрия (0.05%). Затем элюент в течение 10 минут центрифугировали со скоростью 6000 об/мин на лабораторной центрифуге и использовали для хроматографического анализа.
Анализ проводили методом эксклюзионной хроматографии, откалиброванной для анализа белковых соединений, в следующих условиях: хроматограф «Стайер» (г. Москва, НПО «Аквилон»), колонка «Phenomenex» BioSep-SEC-S 3000, размер частиц сорбента – 5 мкм, размер пор – 29 нм, привитая фаза С18, геометрические размеры колонки - 300х7.8мм, объем вводимой пробы 20 мкл, скорость элюирования 1000 мкл/мин, детектор - УФ 280 нм.
Для веществ с высокой молекулярной массой, то есть со временем выхода 10 минут и менее, разделение веществ в колонке проходит по эксклюзионному механизму, по вероятности попадания молекул в поры сорбента. Гидрофильные вещества должны выходить около 11-12 минут, остальные по мере увеличения гидрофобности. После 11 минут из колонки выходят вещества, которые равновероятно способны проникать в поры 29 нм, и принцип разделения превращается в обращенно-фазовый, поскольку на поверхность привита фаза С18.
Калибровочный график строился на стандартных образцах белков и экдистероидов с известной молекулярной массой – свиного тироглобулина, иммуноглобулина А и G, сывороточного и яичного альбумина, миоглобина, а также фитоэкдистероида 20-hydroxyecdysone 80 % чистоты, сухого полуочищенного экстракта левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум) (содержит экдистероиды 20-hydroxyecdysone и ecdysone), парацетамоле и др. По оси абсцисс (X) откладывали значения времени удерживания элюента в хроматографической колонке, характеризующей значения натурального логарифма молекулярной массы, по оси ординат (Y) – пики сигналов.
|
| РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ |
Разделение сложного состава многокомпонентных смесей на молекулы отдельных веществ по размеру, за счет их различной способности проникать в поры сорбента, позволяет провести фракционирование химических веществ с различными молекулярными массами. Получаемые хроматограммы несут информацию об исследуемых веществах, и являются характеристичными для каждого соединения.
Для физиологически активных растительных белков характерным свойством является их высокая гидрофильность и поглощение УФ-лучей при 280 нм, обусловленное наличием ароматических аминокислот. Экдистероиды содержат хромофорную 14a-гидрокси-7-ен-6-он группу с двойными связями, в результате биохимической конверсии они могут образовать двойные связи в положениях 7(9)-11, 24-25, 25-26 или 24-28. При этом происходит сдвиг максимума УФ-поглощения с 242 (254) нм, характерной для химически чистых экдистероидов в растворе этанола, в сторону 300 нм. Большинство фенольных соединений, содержащихся в растительных экстрактах, из-за наличия двойных связей и конъюгации с другими веществами, также обнаруживаются по УФ-отклику в длинноволновой области (300 нм).
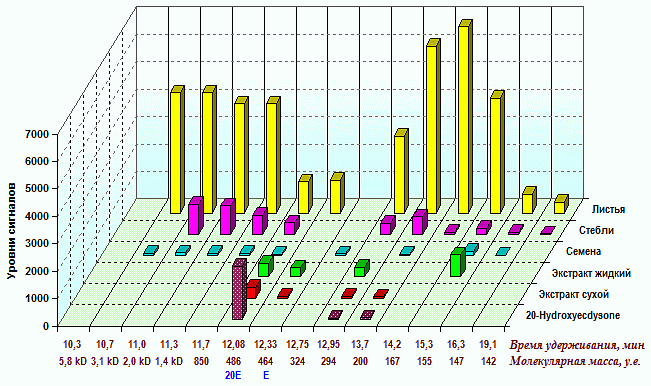
Выявлено 14 пиков в обобщенном хроматографическом “слепке” экстрактов из надземных и подземных органов R. carthamoides (рис. 1). По времени выхода (удерживания) сигнала пики их можно подразделить на 3 зоны: зона пептидов и белковых соединений (левая часть) – 9.5-11.7 мин; зона присутствия экдистероидов (средняя часть) – 11.7-12.3 мин; низкомолекулярных фенольных соединений (правая часть) – 12.7-19.1 мин.
|
|
Рис. 1. Хроматографический профиль препаратов и экстрактов
левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides)
|
|
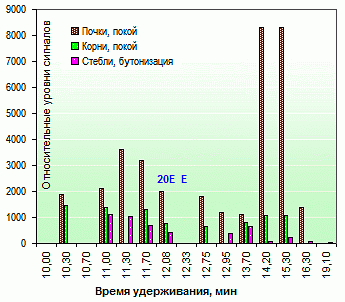
Белки и пептиды. В хроматограммах присутствуют низкомолекулярные белки в диапазоне 6-17 kD – 9.5 мин (17 kD), 10.0 (8.5 kD), 10.3 (5.8 kD); 4 пика пептидов в диапазоне 1-3 kD – 10.7 (3.1 kD), 11.0 (2.0 kD), 11.3 (1.4 kD), 11,7 (0.85 kD). Наличие и относительный уровень концентрации этих соединений четко прослеживаются в экстрактах зимующих органов растений – почках и корневищах (рис. 2). По всей видимости, ткани и органы, подвергнутых экспозиции при аномально высоких или низких температурах, стимулируют синтез стрессовых белков (5.8, 8.5, 17 kD). Короткоцепочные пептиды (M=0.85-1.00) могут выполнять в растениях защитную, сигнальную и гормональную функцию, вызывая системный иммунный ответ на повреждение или проникновение патогенов (антимикробная и антифидантная функция). Для органов, формирующихся в летний период во время фазы бутонизации-цветения, пики этих классов соединений отсутствуют или уровень их минимален.
Экдистероиды. Носителями биологической активности левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум) являются экдистероиды, низкомолекулярные гормональные соединения со структурой С27, С28 и С29. В качестве продуктов распада основных экдистероидов могут быть вторичные С19…С24 аналоги (Балтаев, 2000). Молекулярные массы С27…С27 экдистероидов левзеи Rhaponticum carthamoides лежат в области 462-540 единиц, из которых являются мажорными, или массовыми, 20-hydroxyecdysone (M=486, синонимы: 20E или экдистерон) и ecdysone (M=464, синонимы: E или экдизон).
При исследовании пиков хроматограмм стандартного образца экдистероида и его характеристик по времени удерживания 12.08 и 12.33 мин (рис. 1), и сопоставленных с другими образцами, они определены как сигналы 20-hydroxyecdysone и ecdysone. Для сухого и жидкого экстракта характерно присутствие сигналов этих двух экдистероидов, и одновременно отсутствие сигналов в области высоко- и низкомолекулярных соединений. Это свидетельствует о происхождении их из экдистероид содержащих растений, а также о прохождении технологических операций по очистке от сопутствующих веществ.
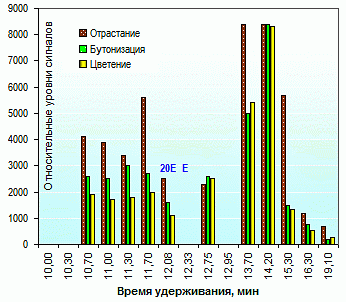
Во всех растительных пробах обнаружено присутствие 20-hydroxyecdysone, причем, исходя из соотношения высот пиков, относительная его концентрации выше в образцах вегетативных (розеточных) побегов, собранных в более ранние фазы развития (рис. 3). Ecdysone содержится в стеблевых листьях генеративных побегов (рис. 1) и практически отсутствует в пробах, представленных тканями почек, молодых корней и розеточных листьев.
|
|
Рис. 2. Хроматограммы экстрактов из зимующих
и летнеразвивающихся органов левзеи
(leuzea, Rhaponticum carthamoides)
|
|
|
|
Рис. 3. Хроматограммы экстрактов левзеи сафлоровидной
из вегетативных побегов по фазам развития
|
|
Состав мажорных экдистероидов левзеи сафлоровидной (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум), уровни их содержания в различных органах (рис. 2-3) соотносятся с результатами количественного ОФ-ВЭЖХ анализа. Концентрация 20-hydroxyecdysone в почках составляет 0.3-0.4 %, корнях 0.1-0.2 %, стеблях 0.1 %; в розеточных листьях она убывает от 0.4-0.5 % (фаза отрастания) до 0.25-0.35 % (бутонизация) и далее, до 0.2 % (цветение). Состав экдистероидов в начале вегетации представлен 20-hydroxyecdysone на 98-100 % (0-2 % E), во время бутонизации – на 94-97 % (0-5 % E).
Следует указать, что в исходных водных растворах фитоэкдистероиды могут находиться в виде гидратов и тригидратов, образовывать новые диеноновые связи (конверсия хромофорного участка в молекуле), а также закрепляться на белковых структурах, что отражается на смещении времени удерживания сигнала в сторону близлежащей области 11.7 мин (M=850). Известны и С54 экдистероиды – димеры 20-hydroxyecdysone, ajugasterone C (M=960-970), а также экдистероиды, связанные с 3-мя сахарами – osladin (M=888).
Низкомолекулярные вещества. Присутствие широкого спектра экдистероидных молекул в растениях сопровождается конъюгацией их с другими, хорошо растворимыми в воде продуктами вторичного обмена веществ: неорганическими (сульфаты, фосфаты) и органическими кислотами (ацетаты, бензоаты, циннаматы), сахарами (глюкозиды, галактозиды, ксилозиды) и т.д. (Лафон, 1998). Молекулярные массы соединений, которые могут выступать совместно в проявлении биологической активности экдистероидов: ацетонид – 40, ацетат – 42, фосфат – 80, бензоат – 104, сульфат – 106, гликозид – 162, циннамат – 164, пальмитат – 238, линолеат – 262, стеарат – 266, 2-3 гликозид – 320-480 единиц.
Пирогаллол имел время выхода сигнала из хроматографической колонки 15,3 мин (M=126), гидрохинон – 16,3 мин (M=120), фенол – 17,5 мин (M=94). В нашем случае пики в хроматограммах отражают всего лишь наличие комплекса низкомолекулярных веществ, и не свидетельствуют в пользу какого-либо из них. Вероятнее всего, подобные вещества (M=300 и менее), являются побочными продуктами биосинтеза лигнина, а также исходным материалом для синтеза таннинов, участвуют в метаболизме и транспорте экдистероидов.
Исходя из литературных данных, левзея сафлоровидная (Leuzea, Rhaponticum carthamoides, maral root, rapontik, маралий корень, рапонтик, рапонтикум) синтезирует значительные количества фенольных и родственных им соединений – 2.0-3.9 % флавоноидов, 1.4-1.9 % водорастворимых производных фенольных кислот. Содержание полифенольных дубильных веществ (таннинов) достигает 9-14 %, а уровень экдистероидов в 10-100 тысяч раз превышает содержание их в других растениях. Фенол и бензойная кислота могут связываться не только с экдистероидами, но и с низкомолекулярными пептидами (Чрикишвили и др., 2006).
|

