В Постановлении Гл. санитарного врача РФ Г. Онищенко № 8 от 06.03.2007 г. “Об усилении надзора за производством и оборотом БАД” отмечается, что стремительно растет число БАД, являющихся источником пищевых и биологически активных компонентов, витаминов и микронутриентов (микроэлементов). В 1-м кв. 2007 г. в обороте на территории РФ находится более 6000 БАД, из которых 30.4 % или 1825 препаратов зарегистрировано в течение одного календарного 2006 года.
При этом выявляются следующие серьезные нарушения при призводстве и реализации БАД:
Учитывая изложенное, различным организациям при производстве, обороте и контроле БАД, в документе предложено:
1.2. При производстве БАД использовать только стандартизованное по содержанию БАВ сырье.
2.1. Внести изменения в документы по новым методов определения и контроля качества БАД к пище.
4.3. Обеспечить выполнение необходимых лабораторных исследований БАД на наличие в них биологически активных компонентов.
5.1. Включить рассмотрение и апробацию новых методов контроля и идентификации БАД на этапах их производства и оборота.
Исходя из актуальности проблемы, ниже приводим современную методику для количественного анализа фитоэкдистероидов: 20-гидроксиэкдизона, экдизона и инокостеронав – в растительном сырье, БАД и лекарственных формах с применением обращенно-фазовой ВЭЖХ. Применяется для определения суммы зкдистероидов в растительном сырье, галеновом препарате, БАД и фитоэкдистероидной субстанции серпухи венценосной Serratula coronata и левзеи сафлоровидной Leuzea carthamoides (при длине волны детектирования 242 нм). В качестве внутреннего стандарта используется п-ацетоамирофенол (парацетамол). Ошибка единичного определения для 20-гидроксизкдизона не превышает 5.6 %. Для сравнения – старый метод ТСХ-анализа (1978 г.) на стеклянных пластинках с колориметрией дает ошибку до 300-400 %.
| Введение |
Фитоэкдистероиды (ФЭС) обладают широким спектром терапевтических свойств. Они оказывают ингибирующее действие на клетки ряда элокачественных опухолей (Амосова и др., 1991), существенно улучшают реологвческиё свойства крови после экспериментального инфаркта миокарда у животных (ГIлотников и др., 1999).
Свойствами неспецифического биостимулятора обладает 20-гидроксиэкдизон (20Е) (Ахрем, Ковганко, 1989). В ближайшем будущем на рынке фаумацевтических прещртов ожидается появление новых фитоэкдистероидосодержащих биостимуляторов фитоэкдистероидосодержащих биостимуляторов и анаболических средств с низкой андрогенной активностью.
Наиболее перспективными продуцентами биолоmчески активных веществ этого класса являются виды родов: Serratula L. (Новосельская, 1977), Rhapoпticuт Ludw. (Вересковский и др 1983), Lychпis L. (Зибарева и др., 1995), Sileпe L. (Зибарева и др., 1997).
В литературе приводятся различные методы количественного определения ФЭС: метод тонкослойной хроматографии (ТСХ) в сочетании с колориметрией (Якубова и др., 1978), метод обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ) (Lafont et аl., 1982; Колегова, Володин, 1999).
Наиболее эффективным является вариант ОФ ВЭЖХ в сочетании с методом внутреннего стандарта (ВС) для градуировки аналитической аппаратуры и математической обработки данных хроматографического анализа. Однако в известных нам публикациях содержится мало сведений об особенностях практической реализации указанного варианта ОФ ВЭЖХ анализа ФЭС.
Цель данной работы – разработка методики для одновременного количественного определения ФЭС: 20-гидроксиэкдизона (20 Е), экдизона (Е) и инокостерона (ИН) в растительном сырье и лекарственных формах с применением ОФ ВЭЖХ в сочетании с ВС.
|
Материал и методика |
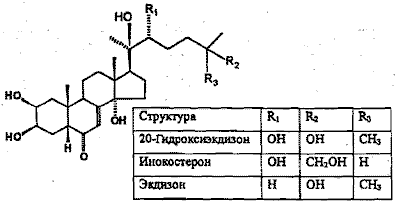
Объектом изучения являлась серпуха венценосная Serratula coroпata L., интродуцированная в Ботаническом саду Институга биологии Коми НЦ УрО РАН. Структурные формулы ФЭС серпухи венценосной представлены на рис. 1. Известно, что максимальное содержание ФЭС в надземной части растений наблюдается в фазы вегетации и бутонизации (Экдистероиды..., 1993).
|
Рис. 1. Стрyктypные формулы основных экдистероидов S. coroпata |
|
Нами исследована надземная часть растений, собранных в фазу массовой бутонизации, а также галеновые препараты, полученные из этого сырья. Определение ФЭС проводили на жидкостном микроколоночном хроматографе “Милихром”, оснащенном УФ-детектором на длине волны 242 нм на колонке 80 х 2 мм (ТОО “Медикант”, г. Орел) с сорбентом “Диасорб 130-С16-Т”, 6 мкм (ЗАО “БиоХимМак”, г. Москва).
Регистрацию и математическую обаботку результатов ВЭЖХ-анализа осуществляли с помощью универсальной компьютерной системы сбора и обработки хроматографической информации “Полихром для Window” (ЗАО “Инфохром”, г. Москва) на компьютере “Pentium 166”.
Количественное содержание ФЭС рассчитывали по методу внутреннего стандарта с применением рабочих стандартных образцов (РСО) ФЭС. РСО были получены в группе биохимических методов исследований лекарственных растений отдела Ботанический сад Института биологии Коми НЦ УрО РАН (Патент № 2138509).
Внутренний стандарт – n-ацетаминофенол (парацетамол), фармакопейный, дополнительно перекристаллизованый из метанола; концентрирующие патроны “Диапак 130-С16-Т” (ЗАО “БиоХимМак”, г. Москва) активированы фильтрованием 10 мл 96 %-ного этанола и 20 мл бидистиллированной воды.
Условия ВЭЖХ. Состав подвижной фазы: вода-этанол-бутанол (72.4:26.8:0.8). Скорость потока элюента 50 мкл/мин, объем вводимой пробы З мкл. Время удерживания, с: ВС – 313, 20Е – 700, ИН – 846, Е – 1675; чувствительность детектора 0.002 опт. ед. Общее время анализа 40 мин.
Построение градуировочных графиков. Градуированную смесь ФЭС (100 мг, содержащую 20Е, ИН и Е в соотношении 86:8:6) и 10 мг парацетамола (точные навески) растворяли в 100 мл дегазированного элюента (раствор А). Затем, путем последовательного разведения раствора А элюентом готовили градуировочные растворы ФЭС с концентрациями 0.1-1.0 мг/мл, с шагом 0.1. Каждый раствор хроматографировали при указанных выше условиях З раза.
Количественное определение 20Е, ИН и Е. Растительное сырье фиксировали 50 %-ным этиловым спиртом непосредственно после отчуждения надземной массы. Перед проведением анализа фиксирующий раствор, содержащий часть ФЭС, декантировали. Растительное сырье измельчали, экстрагировали 50 %-ным этанолом при 60 °С в течение 1.5 ч и при комнатной температуре в течение суток.
Экстракты, объединенные с фиксирующим раствором, упаривали в вакууме, фильтровали, отбирали аликвоту – десятую часть раствора и пропускали его через концентрирующий патрон “Диапак 130-С 16-Т” со скоростью 0.5-1.0 мл/мин. Сумму ФЭС селективно элюировали с сорбента 10 мл 60 %-ного этанола. Элюат собирали в мерную колбу емкостью 25 мл, вносили 4 мл раствора ВС в элюенте (С = 0.625 мгIмл). ВЭЖХ-анализ каждого образца проводили 3-5 раз. |
| Результаты и их обсуждение |
Применение метода внутреннего стандарта ддя ВЭЖХ-анализа сложных по составу образцов экстрактивных веществ позволяет существенно повысить точность количественного определения индивидуальных соединений. Кроме того, метод ВС исключает появление ошибок анализа, связанных с вариацией объемов проб, вводимых в колонку для ВЭЖХ. Следует особо отметить, что именно вариации объемов проб, обусловленные конструкцией хроматографов марки “Милихром’, делают эти приборы малопригодными для анализа с использованием методов абсолютной градуировки или внешнего стандарта. В то же время они вполне пригодны для массовых анализов с применением метода ВС.
В настоящей работе в качестве ВС предлагается использовать парацетамол, содержащий фенильный хромофор с максимумом полосы поглощения в области 238 нм, что практически совпадает с максимумом полосы поглоения хромофора (С = С – С = О) в структуре ФЭС (242 нм). Вместе с тем следует отметить, что молярный коэффициент поглощения парацетамола в данной области спектра в среде выбранного элюента практически в 3 раза больше, чем у ФЭС. В связи с этим массовая доля выбранного ВС должна быть на порядок меньше в градуированных смесях по сравнению с концентрацией ФЭС.
Количественное определение ФЭС методом ВЭЖХ проводили в 2 этапа. Первый этап – определение градуировочных коэффициентов – коэффициентов пропорциональности между соотношением площадей пиков и концентраций 20Е, ИН, Е и ВС.
 |
|
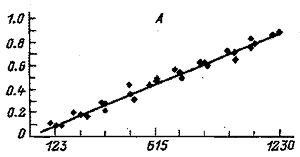
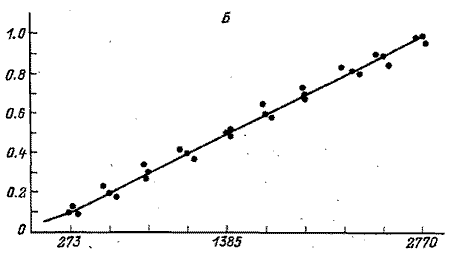
Рис. 2. Градуировочные графики для парацетамола (А)
и для экдистерона (Б)(по оси абсцисс – площадь пика, mB х с;
по оси ординат – концентрация вещества, мг/мл |
|
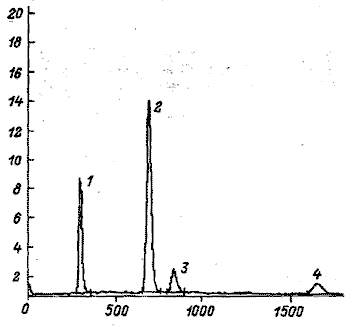 |
Рис. 3. Хроматограмма экдистероидов Serratula coroпata
1 – парацетамол. 2 – зкдистерон, З – инокостерои, 4 – экдизон.
По оси абсцисс – время ВЗЖХ-анализа, с;
по оси ординат – амплитуда сигнала, мВ |
|
Градуировочные графики, отражающие зависимость концентраций ВС и 20Е от площади хроматографических пиков, приведены на рис. 2. С использованием соответствующих им уравнений с помощью программы “Полихром” были рассчитаны градуировочные коэффициенты для определения ФЭС. На втором этапе осуществляли количественное определение ЭС в исследуемых образцах растительного сырья и лекарственных формах. Для расчета содержания определяемых компонентов Х1 (%) использовали следующую формулу:
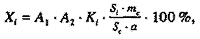 |
где А1 и А2 – коэффициенты, учитывающие объем исходного экстракта, аликвоту экстракта для концентрирования ЭС на патроне и объем пробы для ВЭЖХ; Ki – калибровочный коэффициент ФЭС; Si – площадь хроматографического пика ФЭС; Sс – площадь пика ВС, мВ х с; а – навеска растительного сырья, мг; mc – масса ВС в пробе, мг |
|
Относительную погрешность значений Х вычисляли с помощью соотношения:
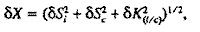
где К(i/c) – коэффициент относительной чувствительности детектора к определяемому компоненту ФЭС и стандарту, который рассчитывали, используя следующее соотношение (где mi – масса i-го компонента) |
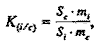 |
|
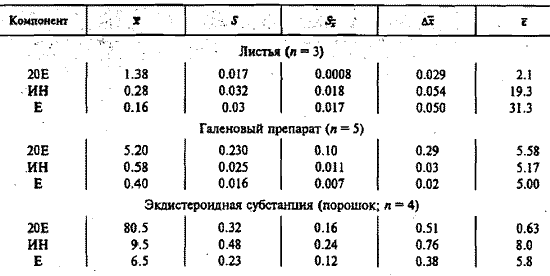
Хроматограмма ФЭС серпухи венценосной приведена на рис. 3. Результаты определения ФЭ в листьях (в пересчете на воздушно-сухое сырье), в лиофилизированном галеновом препарате и фитоэкдистероидной субстанции, полученной многостадийной очисткой галенового препарата от сопутствующих зкстрактивных веществ, представлены в таблице 1.
Таблица 1. Метрoлогические характеристики методики определения 20-гидроксиэкдизона (20Е),
инокостерона (ИН) и экдизона (Е) методом микроколоночной ВЭЖХ (P = 0.95)
|
Примечание. X – среднее значение, S – среднее квадратичное отклонение, Sx – ошибка среднего квадратичного отклонения, Δx – доверительный интервал среднего значения, ε – погрешность среднего значения (а = 0.95), n – число определений.
Согласно полученным результатам, ошибка единичного определения с доверительной вероятностью 95 % для 20E находится в интервале 0.6-5.6 %, ИН = 5.2-19.3, Е = 5.0-31.3 %. Следует отметить, что наименьшая погрешность определения ФЭС наблюдается при сравнительно высоком их содержании в растительном сырье и лекарственных формах.
Представленная методика СФ ВЭЖХ дает возможность оценки качества растительного сырья и лекарственных форм, содержащих ФЭС. Она характеризуется достаточно высокой чувствительностью (предел обнаружения 20Е 0.1 мг/л), селективностью определения и рекомендуется для выполнения массовых анализов растительного сырья при скрининге растений на ФЭС, а также для технологического контроля при производстве фармацевтических препаратов, содержащих 20Е, ИН и Е.
|
| Выводы |
1. Разработана методика количественного определения суммы зкдистероидов в растительном сырье, галеновом препарате и фитоэкдистероидной субстанции серпухи венценосной Serratula coronata L. с использованием обращенно-фазовой ВЭЖХ (при длине волны детектирования 242 нм). Ошибка единичного определения разработанной методики с доверительной вероятностью 95 % для 20-гидроксизкдизона – основного компонента фитозкдистероидной фракции серпухи венценосной не превышает 5.6 %.
2. В качестве внутреннего, стандарта предложено использовать п-ацетоамирофенол (парацетамол). Применение метода внутреннего стандарта в сочетании с СФ ВЭЖХ позволяет повысить точность количественного определения индивидуальных соединений в сложном по составу образце. |
| Список литературы |
Амосова Е.Н., Зуева Е.П., Гольберг Е.Д. Растения Сибири и Дальнего Востока – источники поиска лекарственных препаратор для онкологической практики // Фармакология и токсикологня. 1991. Т. 54, № 6. С. 3-7.
Ахрем А., Ковганко Н. Экдистероиды: химия и биологическая активность. Минск, 1989.
Вересковский В.В., Чекалинская И.И., Пашина Г.В. Динамика содержания зклисгерона у видов рода Rhaponticum Ludw. // Растительные ресурсы, 1983. Т. 19, вып. 1. С. 60-65.
Плотников М.Б., Алиев О.И., Васильев А.С., Маслов М.Ю., Чернышова Г.А., Краснов Е.А., З и б арс в а Л. Н. Гемореолотяческая активность экстрактов из надземной части части Lychпis chalcedoпica L. и Rhapoпticит carthamo;des (Willd.) Iljin при эксперимеи¬тальном инфаркте миокарда // Растительные ресурсы, 1999. Т.35, вып. 1. С. 103-107.
Зибарева Л.Н., Балтаев У.А., Свиридова Т.П., Саатов З., Абубакиров Н.К. Виды рода Lychпis L. – перспективные источники экдистероидов // Растительные ресурсы, 1995. Т. 31, вып. 4. С. 1-9.
Зибарева Л.Н., Еремина В.И., Иванова Н.А. Новые экдистероидоносные виды р. Silene L. и динамика содержания в них экдистерона // Растительные ресурсы, 1997. Т. 33, вып. 3. С. 73-76.
Колегова Н.А., Володин В.В. Обращенно-фазовая высокоэффективная жидкостная хроматография экдистероидов в системах, содержащих электронодонорные добавки // Журнал аналитической химии. 1999. Т. 54, № 12. С. 1285-1288.
Новосельская И.Л. Фитоэкдизоны растений рода растений рода Serratиla: Автореф. канд. дис. Ташкент, 1977.
Пат. 2138509 Россия, МКИ6 А 61 К 35/78. Cпособ получения экдистерокдов растения рода Serratula – а-экдизона, экдизона и инокостерона /
Пунегов В.В., Мишуров В.П., Никитина Е.Н.; Ин-т биологии Коми НЦ УрО РАН. № 97121539; Заявл. 22.12.97; Опубл. 27.09.99. Бюл. № 27.
Экдистероиды растений семейства Asteraceae / В.В. Володин, В.П. Мишуров, Н.А. Колегова, Ю.А. Тюкавин, Н.В. Портнягнна, Б.А. Постников. Сыктывкар, 1993. (Науч. докл. Коми НЦ УрО РАН. Вып. 319).
Якубова М.Р., Генкина Г.Л., Шакиров Т.Т., Абубакиров Н.К. Хроматоспектрофотометрический метод определения экдистерона в растительном сырые // Химия природных соединений. 1978. № 6. С. 737-740.
Lаfont R., Реnnеtiеr J.-L., Аndriаnjаfitrimо М. Sample processing for hiпg-реrfопnасе liquid chromatography of ecdysteroids // J. Chromatography, 1982. Vol. 236. P.137-149.
|
| Реферат - Summary |
Тhe Мethod of Internal Standart for Determination of Ecdysteroids In Herb and Preparation by HPLC Analysis
Pипegov V.V. and Saviпovskaya N.S.
The method, of quantitative determination of sum content of ecdysteroids in nerb, tincture and phytoecdysteroid substance of Serratula coroпata L. By means of HPLC analysis (UV-detection 242 nm) have bееп proposed. Тhе relative errors of the quantification of phytoecdysteroids in this method with confidence probability 0.95 for 20-hydroxyecdysone (the main component of ecdysteroids of Serratula coronata) is поt more then ±5.6 %. Тhе p-acetaminophenol have bееп used as internal standard. The application of HPLC analysis with internal standard allowus tо increase accuracy of quantitative identification of individual components in complex mixtures.
|
Про особенности и различия препаратов из Левзеи, Технология Производства и их Активность описаны на следующих страницах нашего сайта "Экдистен, Левзея и Маралий корень: Заказы, Технология, Дозировка и Активность - Ecdystenum, Rhaponticum-Leuzea and Maral root: Orders, Technology, Dosage, Activity":